Rekonstrukcyjna macierz tkankowa NovoMatrix™
Materiał nowej generacji do augmentacji tkanek miękkich
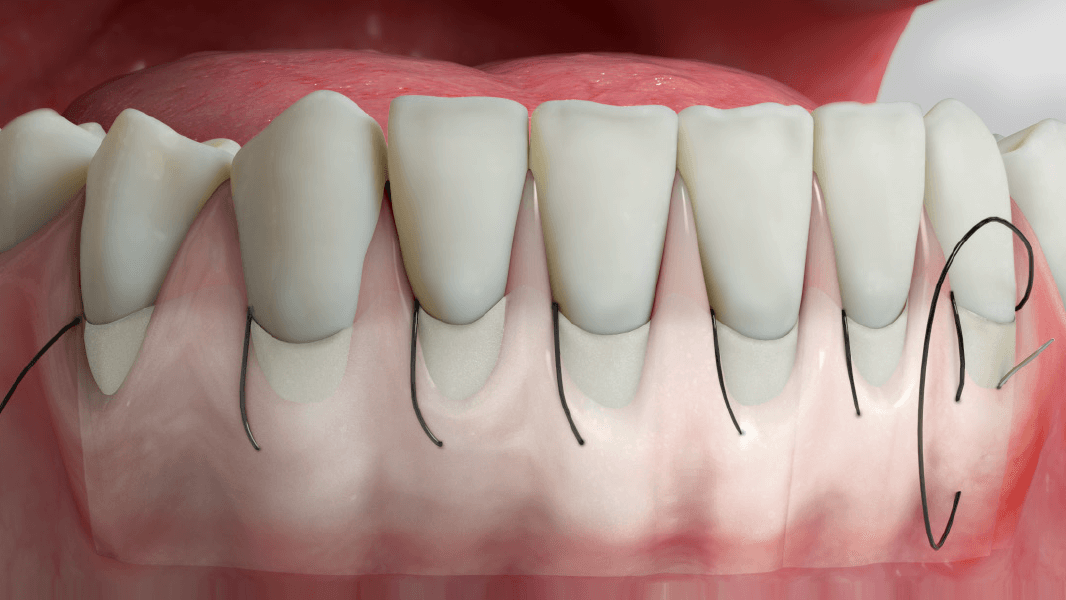
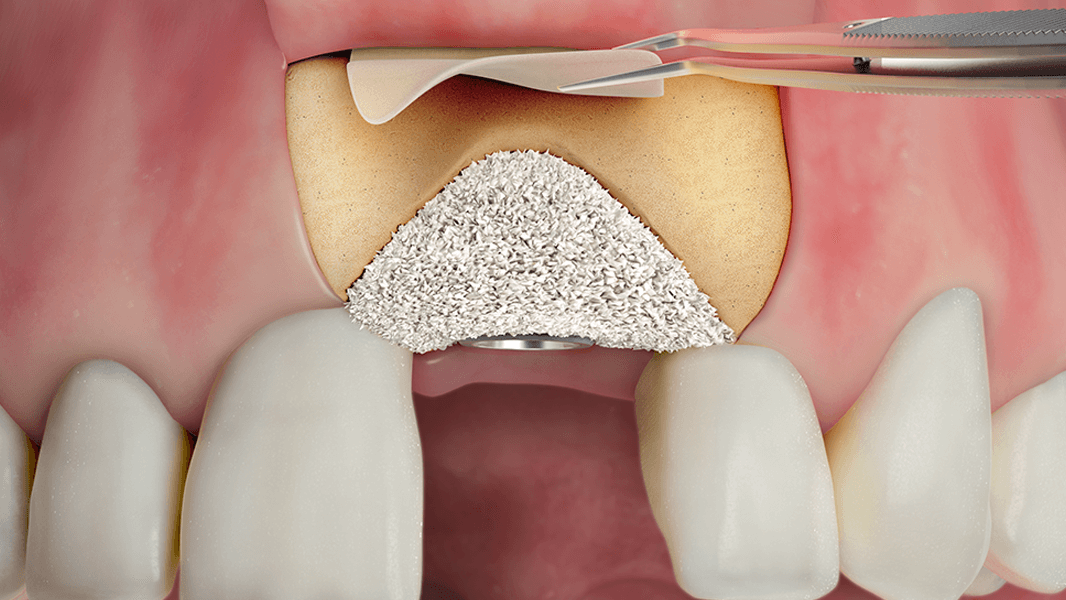
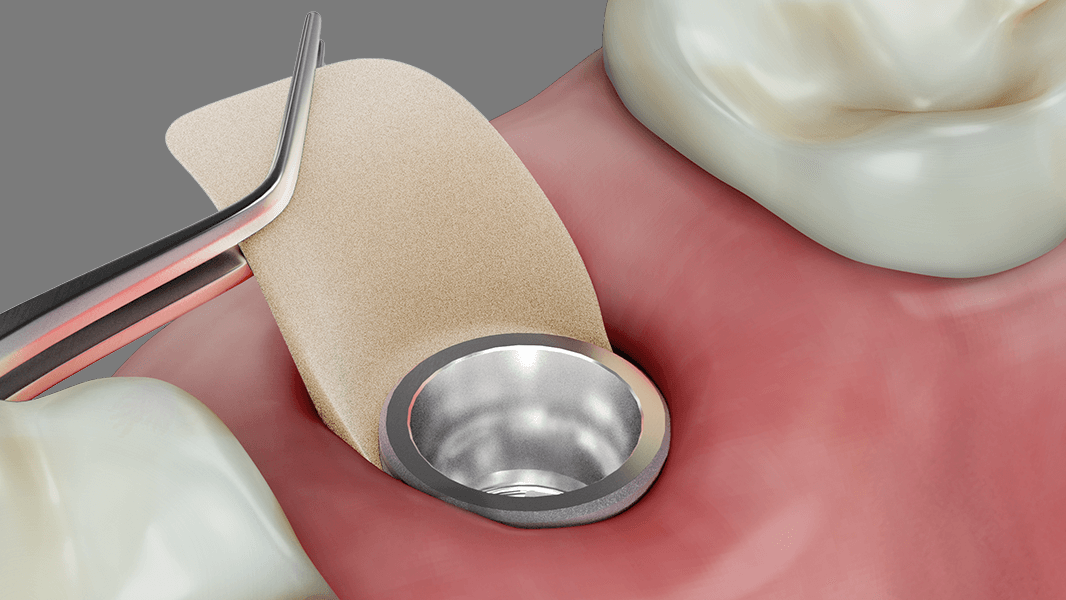
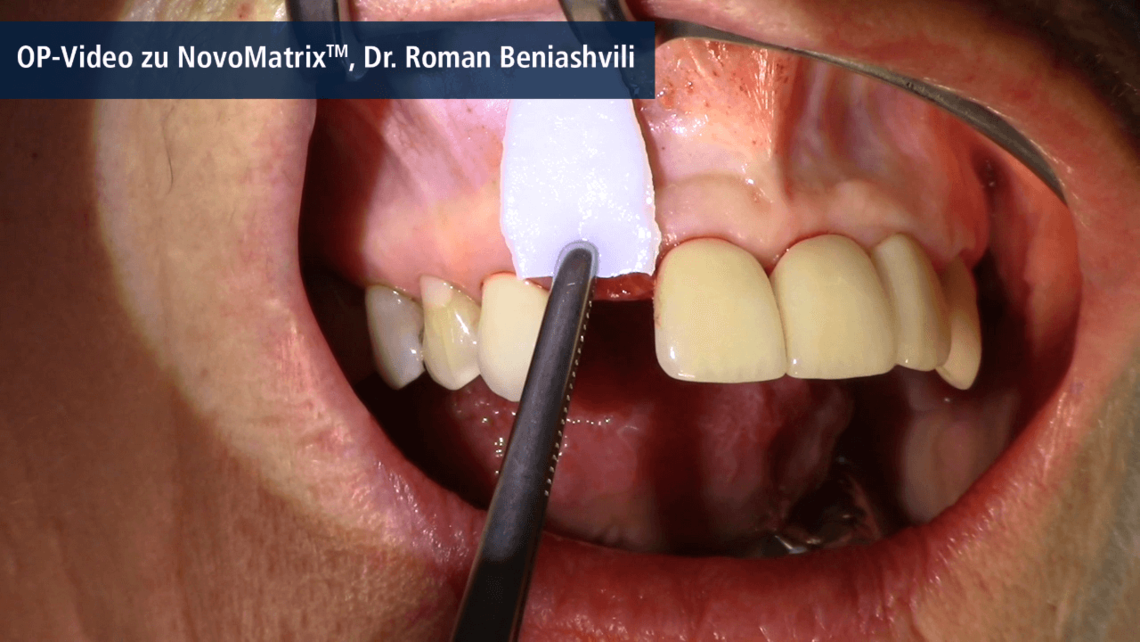
NovoMatrix™ to bezkomórkowa macierz skórna pozyskiwana z tkanki wieprzowej. W zastosowaniach chirurgicznych ta odporna na rozdarcia i łatwa w użyciu1, 2 macierz stanowi doskonałą alternatywę dla autologicznych przeszczepów tkanki łącznej (CTG). Nie ma już potrzeby korzystania z wewnątrzustnego miejsca dawczego do chirurgicznego pobrania przeszczepu, co zmniejsza ryzyko powikłań u pacjenta.
Za sprawą procesu produkcji macierz jest wolna od komórek dawcy. Jednocześnie struktura tkanki pierwotnej pozostaje praktycznie niezmieniona, co wspomaga wrastanie komórek i mikronaczyń. Zastrzeżony proces obróbki tkanki umożliwia optymalną repopulację komórek oraz rewaskularyzację dzięki delikatnej preparacji, co przekłada się na estetyczny wygląd zregenerowanych tkanek miękkich.3
Macierz NovoMatrix™ jest dostarczana w postaci wstępnie uwodnionej w opatentowanym wodnym roztworze buforowanym fosforanami, zawierającym stabilizatory macierzy, dzięki czemu można jej użyć natychmiast, bez konieczności intensywnego ponownego nawadniania.4
NovoMatrix – optymalna do następujących wskazań⁴
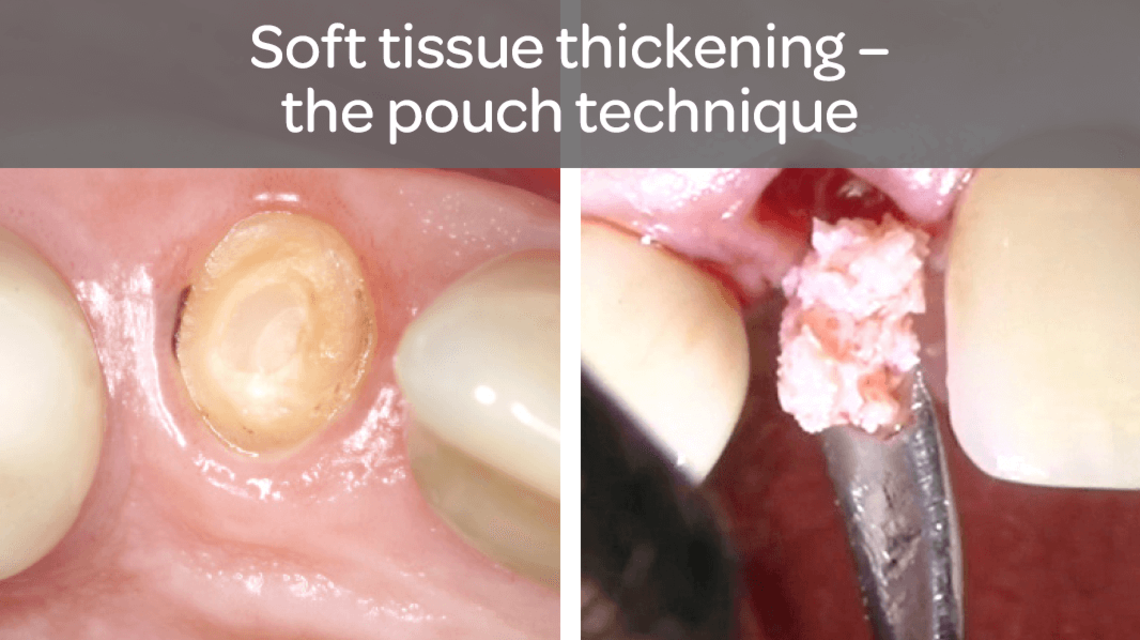
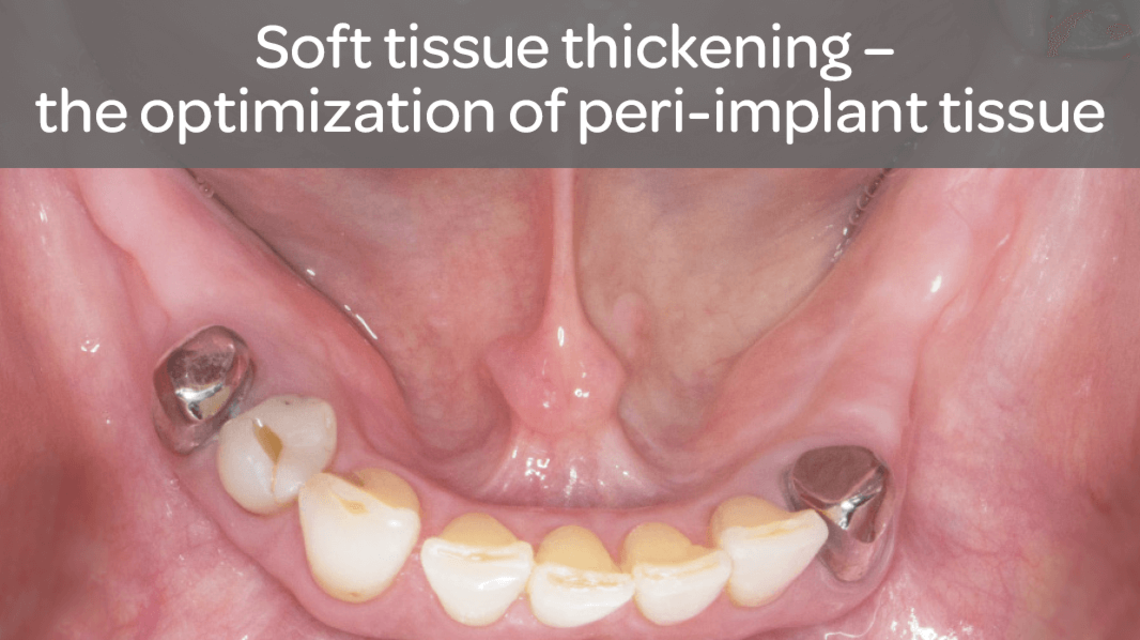
- Zwiększenie ilości tkanki wokół zębów i implantów
- Odbudowa wyrostka zębodołowego na potrzeby uzupełnienia protetycznego
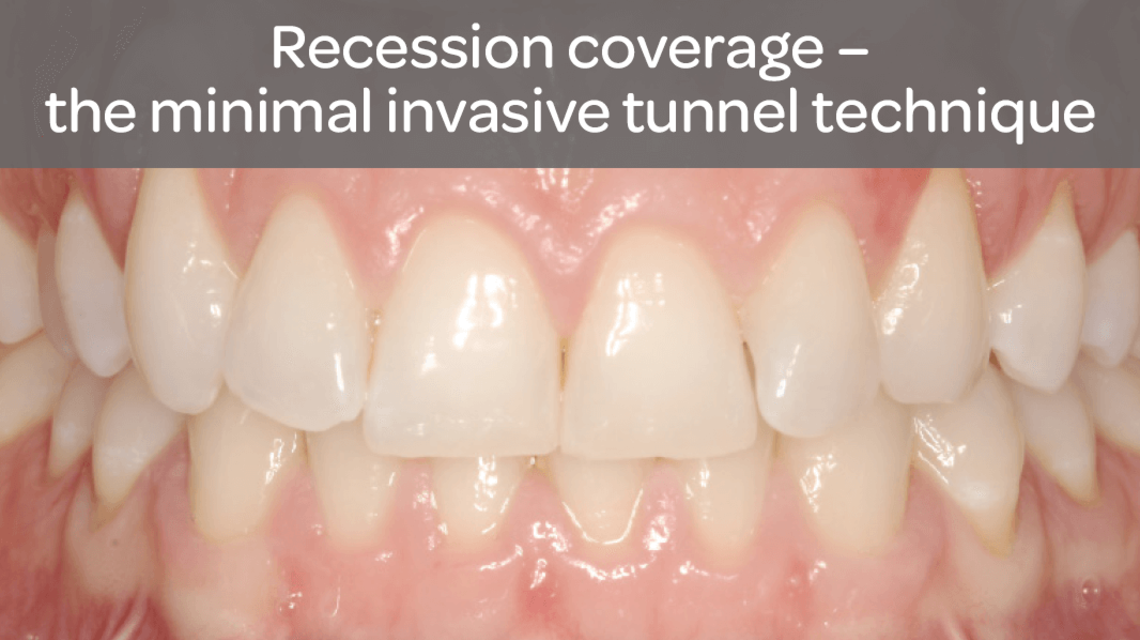
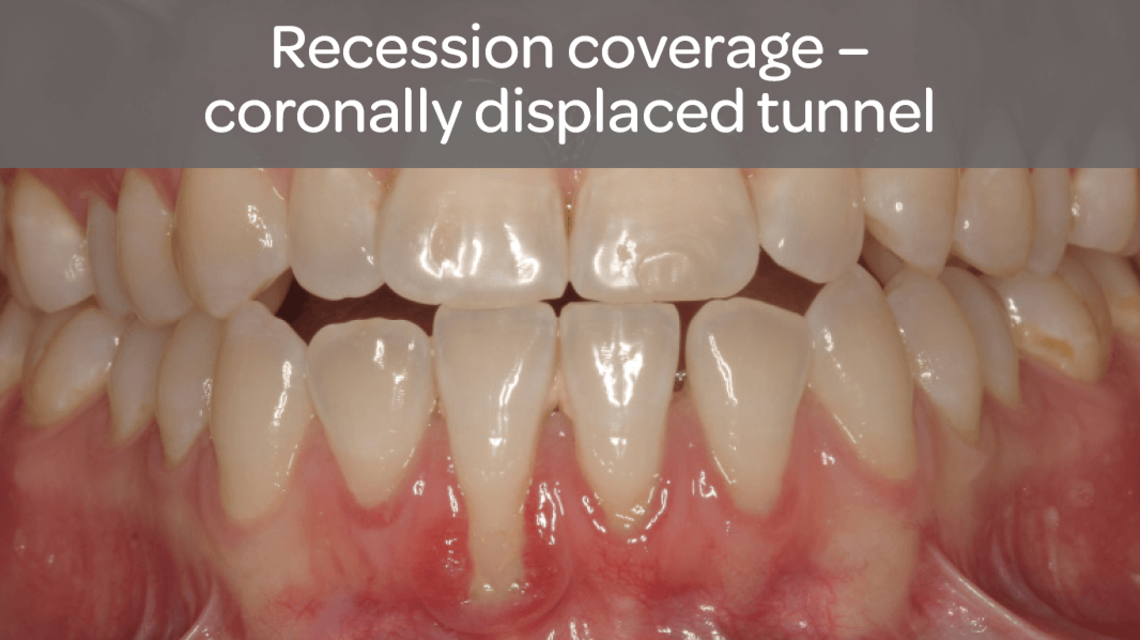
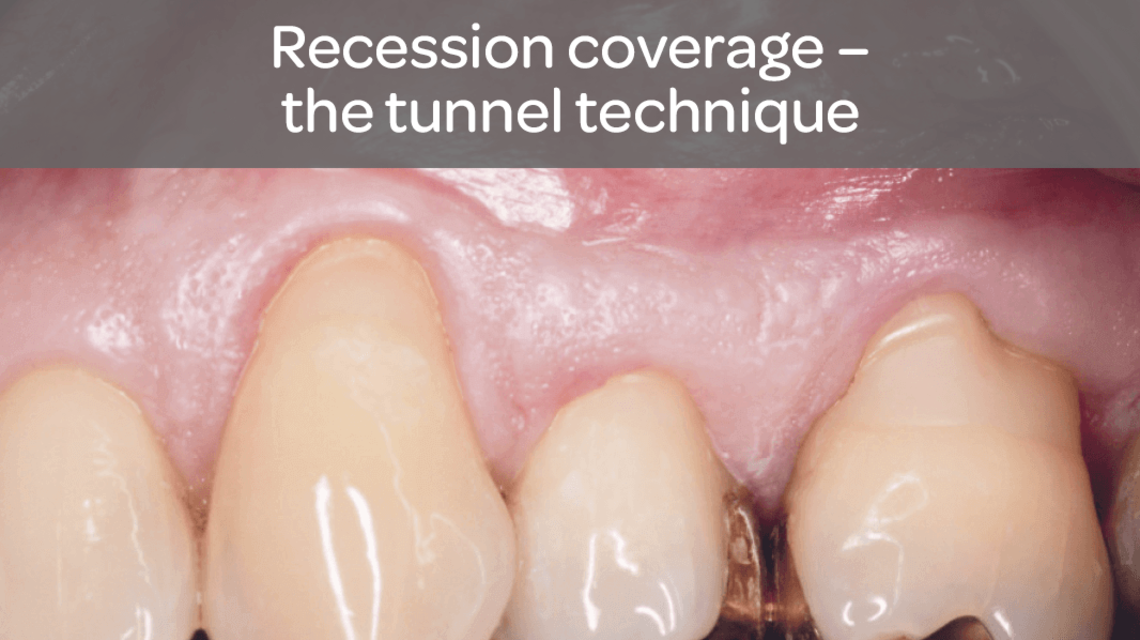
- Sterowana regeneracja tkanek w przypadku recesji dziąsłowych w celu pokrycia korzenia zęba
Właściwości produktu NovoMatrix
- Proces preparacji tkanki LifeCell™ zapewnia szybką rewaskularyzację.
- Stała grubość tkanki przez cały czas
- Wstępnie uwodnione – gotowe do użycia po wyjęciu z opakowania po 2-minutowym namoczeniu w sterylnym roztworze soli fizjologicznej lub płynie Ringera z mleczanami4
- Przechowywanie w temperaturze od -8°C do +30°C4
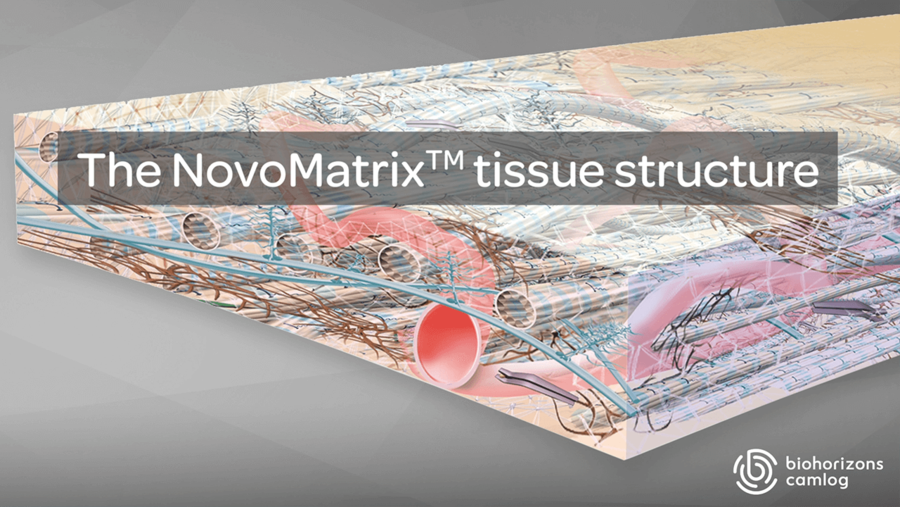
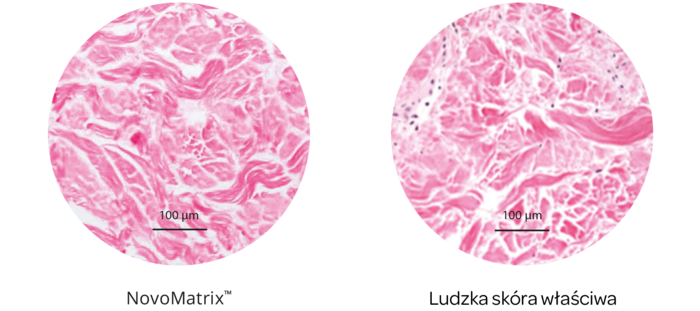
Struktura tkanki NovoMatrix
Utrzymanie integralności przeszczepu ma zasadnicze znaczenie dla uzyskania zadowalających wyników biologicznych. Macierz NovoMatrix poddawana jest minimalnej modyfikacji i delikatnej obróbce, aby zapewnić zachowanie składników krytycznych dla utrzymania biochemicznej i biomechanicznej integralności tkanki.
Zalety stosowania NovoMatrix
- Krótszy czas zabiegu
Gotowa do użycia macierz kolagenowa skraca czas zabiegu, eliminując konieczność pobrania tkanki z drugiego miejsca dawczego.9
- Zmniejszenie powikłań u pacjenta
Eliminacja konieczności pobierania tkanki z miejsca dawczego na podniebieniu eliminuje ból pooperacyjny związany z drugą procedurą.9, 10, 11
- Doskonała integracja tkanek
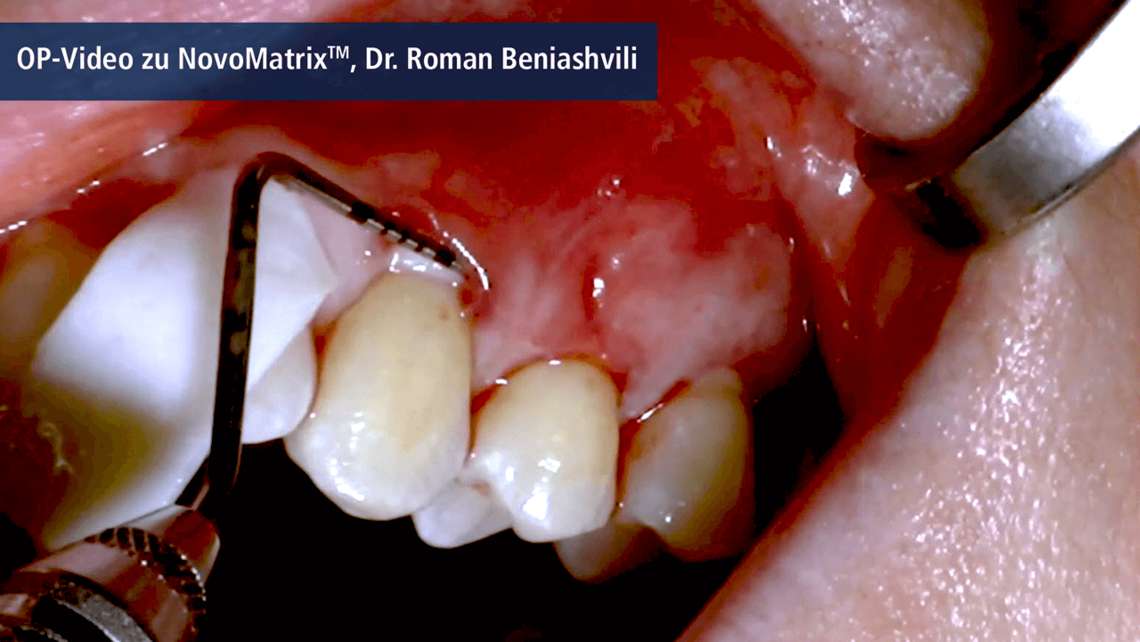
Zastosowanie NovoMatrix™ wspomaga szybką rewaskularyzację, repopulację komórek i minimalizuje reakcje zapalne.3, 8, 12, 13
- Naturalność struktury i koloru tkanki
Zastosowanie macierzy NovoMatrix™ przekłada się na gojenie bez podrażnień oraz bardzo dobrą adaptację koloru i struktury tkanki do naturalnej tkanki otaczającej.14
- Szybkie i niepowikłane gojenie tkanek miękkich
Zastosowanie macierzy NovoMatrix™ wspomaga pozytywną reakcję immunologiczną, a także integrację i regenerację tkanek.3, 12, 13, 15
LifeCell™ – ponad 25 lat doświadczenia
Innowacyjne produkty do odbudowy tkanek
Od ponad dwóch dekad LifeCell™ opracowuje innowacyjne produkty o szerokim zakresie zastosowań. Mając na koncie ponad 2.5 miliona przeszczepów, 25 lat doświadczenia w obróbce tkanek i nieustannie dążąc do innowacji, firma LifeCell™ połączyła siły z BioHorizons i Camlog, by wprowadzić do stomatologii NovoMatrix™, materiał nowej generacji do augmentacji tkanek miękkich.

Instrukcja używania NovoMatrix
Przed użyciem NovoMatrix prosimy zapoznać się z informacjami dotyczącymi bezpieczeństwa zawartymi w instrukcji używania.
Instrukcja używania NovoMatrix jest dostępna w naszym Centrum medialnym.
Piśmiennictwo
Adsorption and Release of Growth Factors from Four Different Porcine-Derived Collagen Matrices
Enhanced Wound Healing Potential of Primary Human Oral Fibroblasts and Periodontal Ligament Cells Cultured on Four Different Porcine-Derived Collagen Matrices
Comparison of two soft tissue substitutes for the treatment of gingival recession defects: an animal histological study
Referencje
| 1 | Data on file, Allergan. NovoMatrix™ – Mechanical testing, Preclinical Data. |
| 2 | Data on file, Allergan. INT/0204/2018. |
| 3 | Suárez-López Del Amo F, Rodriguez JC, Asa‘ad F, Wang HL. Comparison of two soft tissue substitutes for the treatment of gingival recession defects: an animal histological study. J Appl Oral Sci., 2019;27:e20180584. |
| 4 | Reference manufacturer’s Instructions for Use (IFU) package insert. |
| 5 | Necas J, Bartosikova L, Brauner P, Kolar J. Hyaluronic acid (hyaluronan): a review. Vet Med. 2008;53(8):397-411. |
| 6 | Ludwig MS. Proteoglycans and pathophysiology. J Appl Physiol. 2007;103:735-736. |
| 7 | Pankov R, Yamada KM. Fibronectin at a glance. J Cell Sci. 2002;115:3861-3863. |
| 8 | Harper JR, McQuillan DJ. Extracellular wound matrices: a novel regenerative tissue matrix (RTM) technology for connective tissue reconstruction. Wounds. 2007;19(6):163-168. |
| 9 | Griffin T, Cheung W, Athanasios Z, Damoulis P. Postoperative Complications Following Gingival Augmentation Procedures. J Periodontology 2006;77:2070-2079. |
| 10 | Aguirre-Zorzano LA, García-De La Fuente AM, Estefanía-Fresco R, Marichalar-Mendía X. Complications of harvesting a connective tissue graft from the palate. A retrospective study and description of a new technique. J Clin Exp Dent. 2017;9(12):e1439-45. |
| 11 | Tavelli L, Asa’ad F, Acunzo R, Pagni G, Consonni D, Rasperini G. Minimizing Patient Morbidity Following Palatal Gingival Harvesting: A Randomized Controlled Clinical Study. The International Journal of Periodontics & Restorative Dentistry 38(6):e127-e134 November 2018. |
| 12 | Sandor M, Leamy P, Assan P, et al. Relevant in vitro predictors of human acellular dermal matrix-associated inflammation and capsule formation in a nonhuman primatesubcutaneous tissue expander model. Eplasty. 2017;17:e1-e21. |
| 13 | Xu H, Wan H, Sandor M, et al. Host response to human acellular dermal matrix transplantation in a primate model abdominal wall repair. Tissue Eng Part A. 2008;14(2):2009-2019. |
| 14 | Van Orten A. Peri-implant thickening of soft tissue – stable and functional. Implantologie Journal 5 |
| 15 | Sandor M, Xu H, Connor J, et al. Host response to implanted porcine-derived biologic materials in a primate model of abdominal wall repair. Tissue Eng Part A.2008;14(12):2021-2031. |
| 16 | Data on file, Allergan. LRD2011-08-015. |
| 17 | Data on file, Allergan. LRD2013-02-004. |